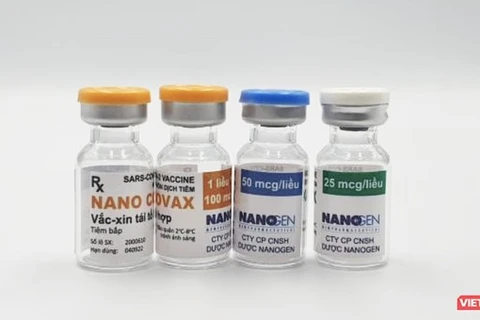
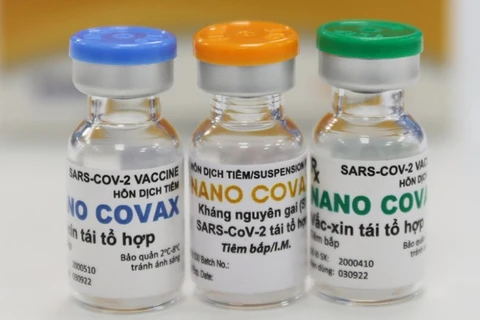
越通社河内——越南卫生部国家生物医学研究伦理委员会一致同意使用Nanocovax疫苗3a期临床试验中期结果评估结论提交专门签发有关药品和药用成分许可证的咨询委员会常委会,以考虑给予Nanocovax疫苗有条件流通许可证。
8月28日发表的关于Nanocovax疫苗3期临床试验结果的新闻公报中,越南卫生部国家生物医学研究伦理委员会强调,Nanocovax疫苗符合安全要求。
新闻公报提及国家生物医学研究伦理委员会在8月22日召开有关截止8月18日疫苗研究结果的紧急会议上就Nanocovax疫苗3期临床试验中期结果评估作出结论,其中,强调所有试验结果都呈现Nanocovax疫苗具有免疫原性。
至于提前考虑给予Nanocovax疫苗有条件流通许可证的提议,便于为当前防疫工作提供服务,国家生物医学研究伦理委员会一致同意使用截至3期试验中期结果评估时间的临床试验结果,向咨询委员会常委会提交有关药品和药用成分许可证的申请,并考虑按规定给予Nanocovax疫苗有条件流通许可证。
国家生物医学研究伦理委员会建议药物生物技术有限责任公司(Nanogen)和研究小组完善更新报告,补充Nanocovax疫苗临床试验研究结果。
新闻公报指出,目前未有具体数据来直接评估 Nanocovax疫苗的保护效力。因此,需要继续遵循研发方案,根据获批的研发方案评估疫苗的保护效力。这就是评估疫苗质量的最重要结果。
卫生部为包括药物生物技术有限责任公司在内的国内疫苗生产商研发疫苗创造了便利条件。
此前,8月7日,国家生物医学研究伦理委员会召开紧急会议,对Nanocovax的1期临床试验结果进行验收,对2期临床试验结果进行评估。(完)
越通社